в данной статье описывается возможный путь имитационного моделирования фрагментов пульсового сигнала лучевой артерии. Предлагается выделить два архетипа пульсовых сигналов, что позволяет более избирательно подходить к структуре имитационной модели. Вводится понятие универсальной моделирующей функции, что вводит единообразие в синтезе моделей сигналов.
пульсовой сигнал, архетип, амплитудно-временные характеристики, моделирующая функция.
Использование пульсовых сигналов лучевой артерии в задачах медицинской диагностики предполагает формализацию пульсовых сигналов, в том числе, путем создания их моделей. Для практической реализации имитационного моделирования сигналов определим их как два архетипа, в смысле исходных базовых образцов, отличия от которых в конкретных пульсовых сигналах вызываются физиологическими особенностями организма. При этом проявляется свойство полиаттракции [1] – одна часть сигналов лучше коррелирует с первым архетипом, а другая часть, соответственно со вторым. Первый архетип назовем S-архетипом (archetype S) – от англ. susceptible (восприимчивый), а второй - V–архетипом (archetype V) - от англ. viscous (вязкий).
На рис. 1 показаны сигналы, характерные для каждого из архетипов. Здесь и далее A – амплитуда сигнала, t – время. Формально перевод формы из одного архетипа в другой можно осуществить применением к S-архетипу операции интегрирования, а к V-архетипу – операции дифференцирования, что иллюстрирует штриховая линия на рис. 1б.
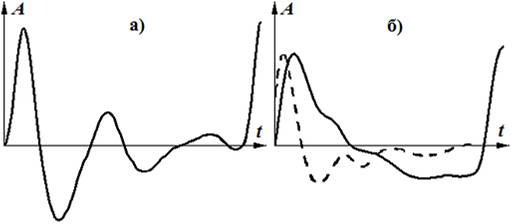
Рис. 1. S-архетип (а) и V-архетип (б) пульсовых сигналов
Далее рассматриваются случаи S-архетипа. Визуально форма одного периода сигнала S-архетипа выглядит как типичное затухающее вынужденное колебание, вызванное импульсным воздействием (в данном случае порцией крови, поступившей в лучевую артерию в область запястья), что использовалось и ранее для моделирования пульсового сигнала [2]. При этом на форму зарегистрированного сигнала влияют различные факторы: особенности датчика пульса, физические нагрузки, эмоциональное состояние, физиологические особенности организма, в том числе эластичность кровеносных сосудов, зависящая в большей степени от возраста и т.д. [3].
Также форма сигнала может иметь в различной степени выраженные особенности, связанные с локальными процессами, протекающими в лучевой артерии в области съема сигнала [4]. На рис. 2 представлен один период сигнала S-архетипа с достаточно выраженным проявлением эффекта искажения формы затухающего колебательного процесса.

Рис. 2. Иллюстрация «симптоматических» дуг д1, д2 и д3
Возможно это проявление эффекта отражения волны от ареала бифуркаций. Под ареалом бифуркаций понимается иерархия разветвлений лучевой артерии, последовательно и древовидно располагающихся за точкой съема пульса, причем, наиболее заметный эффект порождает первое ответвление. Для подчеркивания проявленных локальных особенностей на рис. изображены «симптоматические дуги» дуги д1, д2 и д3, аппроксимирующие и подчеркивающие эти локальные особенности, AS – амплитуда «систолического» зубца, tS – время его появления, AF – амплитуда «дикротического» зубца, tF – время его появления.
Введем понятие универсальной моделирующей аутигенной функции (УМАФ) fu(t), имеющей двойственный характер – с одной стороны функциональная зависимость может отобразить влияние различных факторов, с другой – она аутигенна, т.е. ее применение справедливо для моделирования в определенном локализованном интервале времени:
fu(t) = au(t-τu) h(t-τu) Sin(2π mu du(t-τu)+φu) (1+h(t-τb) (bu(t-τb)–1))+cu,
где: au – амплитудная модуляционная функция, реализующая эффект затухания вынужденного колебания, вызванного импульсным воздействием; h – функция Хевисайда; bu – мультипликативная составляющая для дополнительного микширования (подавления) сигнала – отражает эффект суммарного противодействия различных внутрисистемных факторов проявлению внешнего воздействия, реализуемого после уменьшения амплитуды вынужденного колебания до некоторого сопоставимого (с потенциальным уровнем силы противодействия) уровня в процессе его затухания (гипотетическое проявление «локального» гомеостаза); cu – аддитивная составляющая, вызванная ненулевым средним значением сигнала; du – функция дисторсии времени, отражающая нарушение периодичности колебательного процесса из-за нелинейности системы; mu – масштабирующая временная константа, определяющая начальную частоту моделирующего колебания; φu – начальная фаза моделирующего колебания; τu – начальная временная точка действия УМАФ; τb – начальная временная точка действия bu.
В приведенной формуле:
au(t≤(τu+Δ)) = au(τu); au(t>(τu+Δ)) = au(τu)*e-γσ; σ = (t-τu-Δ)2;
γ – степень нелинейности; Δ – интервал инерции, отодвигающий начало заметного влияния силы, вызывающей затухание амплитуды колебаний; h(t<0) = 0, h(t≥0) = 1; cu(t) = tρ; ρ – степень нелинейности.
Запишем выражение для имитационной моделирующей функции fp(t), моделирующей один период сигнала, начиная с момента tS (рис. 2):
fp(t) = fg(t) + fr(t) + fw(t),
где: fg(t) – основная функция, моделирующая затухающее вынужденное колебание, вызванное импульсным воздействием; fr(t) – корректирующая функция, моделирующая предположительно отраженную от ареала бифуркаций волну вынужденного колебания (см. выше); fw(t) – вспомогательная технологическая функция, моделирующая «рябь» или иные процессы, иногда проявляющиеся в наблюдаемой зоне.
Все функции являются УМАФ. Составляющая fr(t) может отсутствовать. Еще реже возникает необходимость использования компоненты fw(t). Параметры функций определяются по экспериментальным данным [5]. Так, начальная частота основной функции лежит в диапазоне 3,5…5 Гц, а частота корректирующей функции более чем 6-7 Гц. Различие частот затухающего колебания и отраженной волны можно объяснить нелинейностью системы и особым характером формирования отраженной волны. Развернутое выражение пульсовой имитационной моделирующей функции:
fp(t) = ag(t-τg)hg(t-τg)Sin(2πmgdg(t-τg)+φg)+ar(t-τr)hr(t-τr)Sin(2πmrdr(t-τr)+φr)+
aw(t-τw)hw(t-τw)Sin(2πmwdw(t-τw)+φw).
где: φg = π/2, φr = 0, φb = 0; τg – момент систолического максимума выбранного периода сигнала (ts на рис. 2); ag(t=τg) = As, интервал инерции для этой составляющей не более Ω4 (четверть длительности первого периода вынужденного колебания); ar(t=τr) = (0,1…0,2) As, интервал инерции менее Ω4.
Для упрощения убраны мультипликативные и аддитивные составляющие. Величина масштабной временной константы mg определяется, исходя из начальной частоты моделирующего колебания в диапазоне 3,5…5 Гц. Масштабная константа mr определяется, исходя из начальной гипотетической частоты отраженной волны, величиной более чем 6-7 Гц. При этом расстояние от τg до τr чуть более Ω4. Отметим существенное различие частот затухающего колебания и отраженной волны, что объясняется не только нелинейностью системы, но и особым характером формирования отраженной волны.
Заметим, что, в отличие от теоретического импульсного воздействия, импульс порции крови, поступающей в область съема пульса, растянут по времени, а также что наблюдаемый процесс не является затухающим колебанием в классическом виде, а лишь имитируется как таковой.
1. Гучук В.В. Технология объективизации экспертной кластеризации слабо формализуемых объектов / Вестник УГАТУ, 2014. - Т. 18. - № 5. - С. 149-154.
2. Wouter Huberts, Koen Van Canneyt UGent, Patrick Segers UGent. Experimental validation of a pulse wave propagation model for predicting hemodynamics after vascular access surgery. // Journal of Biomechanics, 2012. - № 45 (9). - P. 1684-1691.
3. Илюхин О.В., Лопатин Ю.М. Скорость распространения пульсовой волны и эластические свойства магистральных артерий // Вестник ВолГМУ, 2006. - № 1. - С. 3-8.
4. Бороноев В. В. Анализ пульсовой волны в автоматизированном режиме // Медицинская техника, 2014. - № 4. - С. 33-36.
5. Гучук В.В. Прикладная формализация локального имитационного моделирования пульсовых сигналов лучевой артерии // Интер-медикал, 2015. - № 2. - С.12-17.






